Llamamos
reacción química a la transformación de sustancias, llamadas reactivos, en
otras sustancias con propiedades totalmente distintas, que reciben el nombre de
productos de reacción, con una apreciable variación energética. No hay que
confundir la combinación química con una mezcla. En la reacción química el
cambio producido es profundo y afecta a la propia naturaleza de las sustancias;
en la mezcla, éstas conservan sus propiedades y se produce más una variación de
aspecto que un verdadero cambio.
Expresión
de una reacción
Las
reacciones químicas se representan mediante ecuaciones. Una ecuación química
consta de dos términos separados por una o dos flechas, que indican el sentido
de la reacción. En el término de la izquierda están las fórmulas de las
sustancias reaccionantes, y en el de la derecha, las de los productos de
reacción.
Ejem: 2H2
+ O2 à 2H2O
Las fórmulas van precedidas por unos números o
coeficientes, que indican la proporción en número de moléculas con que
intervienen cada una de las sustancias. Como cada mol de moléculas tiene una
masa determinada, la ecuación nos da información también de la proporción en
masa entre las sustancias, y en el caso de que intervengan gases, esta
proporción se extiende a los volúmenes.
Clasificación de reacciones
químicas: síntesis, descomposición, desplazamiento simple y doble;
óxido-reducción y neutralización
Son muchos
los criterios por los cuales se pueden clasificar las reacciones químicas, una
de las más usadas es por su forma, de tal forma que pueden ser reacciones de: síntesis, descomposición, desplazamiento
simple, y desplazamiento doble.
Reacciones de síntesis: Decimos que una reacción es de síntesis cuando dos
o más sustancias reaccionan entre sí para dar otra de mayor complejidad. La
ecuación general sería: nA + mB à rAB, donde A y B son dos elementos o dos
compuestos, y AB el compuesto que se ha formado por la fusión de ambos, siendo
m, n y r sus coeficientes. Por ejemplo, el azufre sólido se combina con el
oxígeno del aire para dar dióxido de azufre:
S + O2
à SO2
Reacciones de descomposición: Es el proceso contrario al caso anterior,
ya que una sustancia compleja se descompone para dar dos o más elementos o
compuestos más sencillos. Su ecuación general seria: rAB à nA + mB. Un buen ejemplo sería el clorato
de potasio que se descompone con el calor, obteniéndose cloruro de potasio y
oxigeno:
KClO3
à KCl + O2
Reacciones de desplazamiento simple: Son reacciones en que uno de los
elementos de un compuesto es sustituido por otro. Su ecuación general es: AB +
C à AC + B. Por ejemplo, en la reacción el
zinc sustituye al cobre del sulfato de cobre (II):
Zn + CuSO4
à Cu + ZnSO4
Reacciones de desplazamiento doble: En estas reacciones tienen lugar el
intercambio de un elemento o un grupo de elementos entre dos sustancias
reaccionantes: AB + MN à AM + BN.
El alcohol
metílico, CH3OH, en contacto con el ácido acético, CH3COOH,
da lugar mediante una reacción reversible a acetato de metilo y agua:
CH3OH
+ CH3COOH ↔ CH3COOCH3
+ H2O
Otra forma
de clasificar a las reacciones químicas es por su mecanismo, de tal forma que
existen reacciones de: óxido-reducción,
y acido-base o neutralización.
Reacciones óxido-reducción: El concepto actual de oxidación-reducción es un concepto
electrónico; oxidación es un
fenómeno por el cual una sustancia pierde electrones, mientras que reducción es el fenómeno contrario en
que se ganan electrones. Estos dos fenómenos son siempre simultáneos, de manera
que los electrones que reducen una sustancia son los que ha perdido la otra que
se ha oxidado. Su ecuación general seria: R + O à Rn+ + On-, donde R
seria la especie oxidada o agente reductor
(cede electrones) y O la especie reducida o agente oxidante (recibe electrones). Un ejemplo sería la oxidación
del hierro:
Fe + O2
à Fe2O3
Fe à Fe+3 + 3e-
(oxidación o perdida de electrones)
O + 2e-
à O-2 (reducción o ganancia de
electrones)
Reacciones acido-base o de neutralización: Son aquellas reacciones entre un ácido y
una base produciendo sal y agua generalmente. Los ácidos son sustancias con
ciertas propiedades: sabor agrio, reaccionan con algunos metales desprendiendo
hidrógeno, colorean de rojo una disolución azul de tornasol, conducen la
corriente eléctrica en disolución acuosa, etc. Por otro lado, las bases tienen
las siguientes propiedades: sabor amargo, consistencia jabonosa, colorean de
azul una disolución roja de tornasol, condicen en disolución la corriente
eléctrica y reaccionan con los ácidos neutralizándolos.
La
ecuación general de una reacción de neutralización seria: Ácido + Base à Sal + H2O
Por ejemplo,
la reacción entre ácido clorhídrico con hidróxido de sodio generando cloruro de
sodio más agua:
HCl + NaOH
à NaCl + H2O
Balanceo de ecuaciones químicas
El balanceo de ecuaciones no es más que una
consecuencia de la ley de conservación de la masa de Lavoisier, por lo que la
masa de los reactivos debe ser igual a la masa de los productos, esto implica
que la cantidad y variedad de átomos presentes en los reactivos debe mantenerse
en los productos, (lo único que varía es la forma en que están combinados).
Para balancear una ecuación química primero tenemos que identificar el tipo a
la que ésta pertenece. Como ya se mencionó previamente las reacciones químicas
pueden clasificarse en términos generales como ácido-base u óxido-reducción.
Balancear en términos simples significa encontrar los coeficientes estequiométricos
en una reacción tal que la cantidad de átomos presentes en los reactivos sea
igual a aquellos presentes en los productos. Ejemplo:
Fe2O3
+ C à
Fe + CO se balancea como Fe2O3
+ 3C à
2Fe + 3CO

El método que se empleó en el ejercicio previo se llama método algebraico y es útil para
reacciones acido-base, en las cuales únicamente se debe balancear la masa. Sin
embargo, en las reacciones de oxido-reducción se debe balancear tanto la masa
como la carga, por ende, su método es un tanto más complejo y se denomina método redox y a continuación se
explica su método:
- 1. Identificar el tipo de reacción. Es de suma importancia saber si es una reacción ácido-base o de oxido-reducción para poder determinar que método emplear. Para hacerlo es necesario asignar los estados de oxidación de cada átomo en cada una de las especies involucradas. Ejemplo:

Como
se pude apreciar, el cromo gana electrones pues disminuye su estado de
oxidación (de +6 a +3), se reduce, mientras que el arsénico pierde electrones,
es decir, se oxida, pues aumenta su estado de oxidación (de +3 a +5), por lo
que la reacción anterior se clasifica como a una reacción redox.
- 2. separar la reacción en dos semi-reacciones. A pesar de que las reacciones de oxidación y reducción ocurren de forma simultánea, para fines del balanceo, separa la reacción redox en dos semi-reacciones: una semi-reacción de oxidación y una semi-reacción de reducción:
Después
de separar las semi-reacciones se tendrá que balancear por separado.
- 3. Balancea la masa y la carga del átomo que se oxida. Nótese que en la oxidación siempre aparecen los electrones en el lado de los productos.

- 4. Balancea la masa de todas las demás especies presentes. Es decir, aquellas que no cambian su estado de oxidación. En este caso concreto, sólo el oxígeno es quien no cambia. Como del lado izquierdo de la ecuación hay tres átomos de oxígeno y en el derecho hay ocho, es necesario agregar 5 átomos de oxígeno con exactamente el mismo estado de oxidación con el que aparece en los productos.
- 5. Sustituir los iones O2-. Frecuentemente en las semi-reacciones aparece el ion O2- ya sea del lado de los productos o de los reactivos. Dado que no es una especie química aislada, es necesario sustituirla por H2O u OH-. Por ende debemos decidir si la reacción se efectúa en medio básico o ácido, pues la forma de eliminar el O2- depende de las condiciones del medio.
En medio ácido cada ion O2-
se sustituye por H2O:

Continuando
con el caso que se planteó al principio, sustituiremos los iones O2-,
en medio ácido:

Nota: La información que indicará si se
debe balancear en medio ácido o básico se puede obtener en la misma reacción,
observando si aparece algún ácido o base en los reactivos indicados.
Con esto concluye el balanceo de la
semi-reacción, lo que sigue por hacer es repetir los pasos para balancear la
otra semi-reacción:
Balancear la masa y carga del átomo que se reduce:

Balancear la masa de todas las demás
especies presentes:
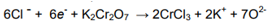
Sustituir
los iones O2- (en medio ácido como en la semi-reacción de
oxidación):

Nótese que ya ambas semi-reacciones
están balanceadas tanto en masa como en carga:


Ahora lo único que resta es garantizar que
los electrones generados por la oxidación sean los mismo que los consumidos en
la reducción. Una forma sencilla es mediante el siguiente procedimiento:
Dado que la reducción consume 6 electrones
y la oxidación produce 4 electrones, habrá que multiplicar todos los
coeficientes de la reducción por 4 y los de la oxidación por 6 y así ambas
reacciones intercambiarán 24 electrones:

Posterior a este paso solo es necesario sumar, cancelar y agrupar las especies que aparecen tanto en reactivos como en productos:

Agrupando y reduciendo quedaría:

Nótese que la ecuación está correctamente
balanceada en masa como en carga, sin embargo, no es eléctricamente neutra.

Hay 24 iones Cl- en los
reactivos. Dado que no existen los iones negativos aislados de los positivos,
solo es necesario decidir que ión positivo debe acompañarlo. Debemos recordar
que la ecuación ya está balanceada por lo cual cualquier ion que agreguemos del
lado de los reactivos se debe agregar del lado de los productos. Es factible
que el ion que lo acompañe sea el H+ ya que el balance se hizo en
medio ácido. Como hay 24 iones de cloruro, estos hay que remplazarlos por
24HCl, y añadir 24 iones H+ del lado de los productos:

Cambia por:

Agrupando quedaría:

Ahora la reacción es eléctricamente neutra y perfectamente balanceada. Es importante recalcar que el balanceo metódico adicionó las sustancias HCl y H2O, que no aparecían originalmente en el caso que se planteó en un principio.
Estequiometría
La
estequiometría es la parte de la química que estudia el cálculo de las
relaciones cuantitativas entre reactantes y productos en el transcurso de una
reacción química.
Así pues,
los cálculos estequiométricos son el
conjunto de los cálculos de masas y de volúmenes que se pueden realizar en una
reacción química gracias a los coeficientes de la ecuación, llamados también
coeficientes estequiométricos, ya que expresan, la relación en número de
moléculas entre las sustancias que intervienen en la reacción. Para realizar
estos cálculos conviene tener en cuenta una serie de normas:
-
Escribir
la reacción colocando a la izquierda las fórmulas de las sustancias
reaccionantes, separadas por el signo de la suma (+), y a la derecha las
fórmulas de los productos de la reacción, separadas también por el mismo signo.
Entre las sustancias reaccionantes y productos se interpone una flecha que
indica el sentido de la reacción (à).
-
Igualar
la reacción colocando los coeficientes de tal manera que el número de átomos de
cada elemento sea igual en cada uno de los dos términos de la ecuación.
-
Localizar
entre los datos aquellos que expresen cantidad: la masa, el número de moles o
el volumen de sólidos, líquidos o gases, siempre que vaya acompañado de su
densidad, o bien el volumen de un gas junto con la temperatura y la presión a
la que ha sido medido. Una vez localizados, transfórmalos en número de moles de
la sustancia.
-
Calcular
a través de los coeficientes estequiométricos el número de moles de la
sustancia deseada.
-
Una
vez conocido el número de moles de la sustancia objeto del problema, calcular
la cantidad en la forma que ha sido requerida.
Ejemplo:
¿Qué volumen de hidrógeno en condiciones
normales se puede obtener con 11.16g de hierro y el ácido clorhídrico
necesario, sabiendo que la reacción da cloruro de hierro (III) y que la masa
atómica del hierro es 55.8? R:
La ecuación ajustada será: 2 Fe + 6 HCl à 2 FeCl3 + 3 H2(g)

Termoquímica: reacciones
endotérmicas y exotérmicas
En toda
reacción química hay que considerar, además de las transformaciones que afectan
a la materia, aquellas que afectan a la energía. Incluso en muchas ocasiones,
la utilidad de una reacción química radica precisamente en la energía que se
produce en ella. Es el caso de las combustiones, las pilas galvánicas o los
explosivos.
Reacciones endotérmicas: Se da el nombre de reacciones endotérmicas a las
transformaciones químicas en las cuales la energía de sustancias reaccionantes
es inferior a la de los productos de la reacción. Para que estas reacciones
tengan lugar ha de existir un aporte de energía del exterior. Este aporte de
energía puede ser espontáneo o bien puede ser producido de una forma forzada.
Reacciones exotérmicas: Cuando se realizan algunas reacciones, la energía
de las sustancias reaccionantes es superior a la de los productos de la
reacción. En este caso hay una pérdida de energía por parte del sistema,
entendiendo por sistema las sustancias químicas objeto de estudio. Esta
energía, como es natural, no se destruye, sino que pasa al ambiente. Estas
reacciones reciben el nombre de exotérmicas, y son las más frecuentes.
Primer
principio de la termodinámica
El primer
principio de la termodinámica es la expresión de la conservación de la energía:
la energía no puede ser creada ni destruida; solamente puede ser transformada
de una a otra forma y transferida de un lugar a otro. La energía interna E de
un sistema depende de la posición y el movimiento de sus moléculas y átomos.
Cuando existe una reacción química, esta energía varía y se puede convertir, en
general, en calor y trabajo. La variación de energía del sistema se puede
expresar como ∆E = w + q, donde w es el
trabajo, q el calor y la letra delta, ∆, significa variación. Este calor y este
trabajo dependen de la forma en que se ha realizado la reacción, pero su suma
sólo depende de los estados inicial y final. Si el trabajo es sólo de expansión
(aumento o disminución de volumen), se puede calcular como: w= - P ∆V.
De estas magnitudes, la
que mejor se puede medir es el calor, realizando la operación dentro de un
calorímetro. Si se fija la presión, el calor sólo dependerá de los estados inicial
y final, y se denomina entalpía, H. Las variaciones de la entalpía
pueden calcularse con la siguiente expresión: ∆H = ∆E + P∆V.
Espontaneidad de un
proceso
El factor energía no es
suficiente para saber con seguridad si una reacción es espontánea o no. Ya se
ha visto que hay fenómenos espontáneos y endotérmicos. Estos procesos tienen
todos una característica común: aumenta la movilidad de sus moléculas. Por
ejemplo, un sólido desaparece y se forma un líquido o un gas; se disuelve un
sólido; se vaporiza un líquido, etc., y existe en todos los casos lo que se
denomina un incremento del desorden molecular. La magnitud que expresa este
desorden se llama entropía, y se
simboliza con la letra S.
El valor numérico de la entropía es el
cociente entre el calor que se desprenderá o absorbería si el proceso se
realizara muy lentamente y la temperatura absoluta. Tampoco la entropía, por si
sola sirve para predecir la espontaneidad. Existe una magnitud, denominada
energía libre o energía de Gibbs, G, cuya variación nos da esta
información: ∆G = ∆H – T ∆S. Si ∆G > 0, el proceso no es espontáneo; si ∆G
< 0, es espontáneo y si ∆G = 0, el proceso está en equilibrio.
· Equilibrio químico: contante de equilibrio
y el principio de Le Chatelier (catalizador, temperatura, concentración,
presión)
Cuando en una
reacción química los productos de la reacción pueden transformarse en
sustancias reaccionantes que vuelven a regenerar las sustancias reaccionantes
de la primera reacción, decimos que es una reacción
de equilibrio. Sea la reacción aA + bB ↔ cC + dD, en que la
doble flecha nos indica el doble sentido de la reacción. La velocidad de la
primera reacción irá disminuyendo, ya que se van consumiendo las sustancias
reaccionantes y disminuye su concentración, mientras que la velocidad de la
reacción inversa aumentará, al irse incrementando los productos de la reacción.
Pero, a partir de un determinado momento, ambas velocidades serán iguales, y
aunque las reacciones seguirán produciéndose, la composición química de mezcla
no variará.
Leyes de
equilibrio
Si la
velocidad de la reacción directa, es según las concentraciones Vd =
kd [A]a [B]b, y la velocidad de la reacción
inversa es vi = ki [C]c [D]d, en el
equilibrio estas dos velocidades serán iguales. Luego, igualando las expresiones
matemáticas, se tendrá:

Siendo Kc
una constante que resulta de dividir las constantes de velocidad de las
reacciones directa e inversa, que se llama constante
de equilibrio. Esta constante sólo varía con temperatura. Si la reacción es
entre gases, se puede definir otra constante de equilibrio parecida, pero que
en vez de estar formada por las concentraciones lo está por las presiones
parciales, entendiendo por presión parcial la que ejercería un gas si estuviera
solo en un recipiente:

La relación entre Kc
y Kp es Kp = Kc (RT)∆n, donde ∆n es la
variación den número de moles de gas que se puede observar en la ecuación
química. Si a un sistema en equilibrio se le cambia alguna variable, rompiendo
el equilibrio, éste reacciona de tal manera que tiende a anular la variación
introducida (Principio de Le Chatelier).
Como se ha
comentado previamente, el equilibrio químico representa el balance entre las
reacciones directa e inversa. Sin embargo, existen variaciones en las
condiciones experimentales (temperatura,
presión, volumen, concentración de reactantes o productos) que pueden
alterar este balance y desplazar la posición de equilibrio, haciendo que se
forme mayor o menos cantidad del producto deseado.
El
principio de Le Chatelier postula que, si un sistema en equilibrio se somete a
un cambio de condiciones, éste se desplazará hacia una nueva posición a fin de
contrarrestar el efecto que lo perturbó y recuperar el estado de equilibrio.
Ejemplos:
Variación de la temperatura
En una
reacción exotérmica:
A + B ↔ C +
D ∆H < 0 o A + B ↔ C + D + calor
En una reacción
endotérmica:
A + B ↔ C + D ∆H>0 o A + B + calor ↔ C + D
Podemos
observar que un incremento en la temperatura favorecerá el sentido que consuma
parte de ese exceso de calor, mientras que una disminución de la temperatura
favorecerá el sentido que regenere parte del calor eliminado.
De tal
forma que podemos decir que: Si aumenta
la temperatura, favorece el sentido endotérmico de la reacción, y en su
contrario una disminución de la
temperatura, favorece el sentido exotérmico de la reacción.
Variación de la presión y volumen
Si incrementa la presión de un sistema gaseoso en
equilibrio, disminuye el volumen, entonces el sistema se desplaza hacia donde hay menor número de moles.
Caso
contrario si la presión de un sistema
gaseosos en equilibrio disminuye, el volumen aumenta, de tal forma que el
sistema se desplaza hacia donde hay mayor número de moles:
CO(g)
+ 3 H2 ↔ CH4(g) + H2O(g)

Nótese
que, al disminuir el volumen del sistema en equilibrio, incrementa la presión
interna, y consecuente a esto la reacción buscará disminuirla, desplazándose
hacia donde exista menor número de moles, por lo tanto, favorece el sentido
directo de la reacción, hasta restablecer el estado de equilibrio.
Variación de la concentración
Al incrementar
la concentración de una sustancia que se encuentra en un sistema en equilibrio,
el sistema se desplazará de modo que utiliza parcialmente la sustancia que se
agregó. Por su parte, una disminución de la concentración de dicha sustancia
ocasionará que el sistema se desplace en el sentido que le permita reemplazar
parcialmente la sustancia que fue removida.
Dicho de
otro modo, incrementar la concentración
de un reactivo en un sistema en equilibrio, favorecerá el sentido directo de la
reacción, e incrementar la
concentración de un producto dentro de un sistema en equilibrio, favorecerá el
sentido inverso de la reacción.
Este
principio es muy utilizado en la bioquímica metabólica.
Catalizador
Un
catalizador por definición es, una
sustancia que acelera o retarda una reacción química sin participar en ella.
Estos actúan sobre la rapidez con la que se alcanza el equilibrio, pero no
modifican la composición del sistema, y por ende, no afectan el valor de la
constante de equilibrio.

Observe
que en la imagen se muestra el efecto del catalizador dentro de un sistema en
equilibrio, el cual favorece a que la velocidad de reacción sea mayor, en otras
palabras, el tiempo que se necesitará para generar los productos será menor.
